Potentiella faror med ”TriFluorättiksyra” (TFA)
skriven av Pavel Makhnatch (under handledning av Rahmatollah Khodabandeh och Björn Palm)
HFO förs nu fram som en grupp köldmedier för framtiden, utan de gamla HFC-mediernas höga växthuseffekt. Det finns dock ett par frågetecken rörande dessa mediers miljöinverkan och säkerhet, utöver deras brännbarhet. Det som mest förts fram i detta avseende är potentialen att bilda vätefluorid och trifluorättiksyra (TFA). I våra tidigare artiklar i denna serie diskuterade vi några av dessa farhågor, men problemet med TFA har inte diskuterats i någon detalj. Denna artikel kommer därför att fokusera på TFA, hur det bildas och dess eventuella miljöinverkan.
Vad är TFA?
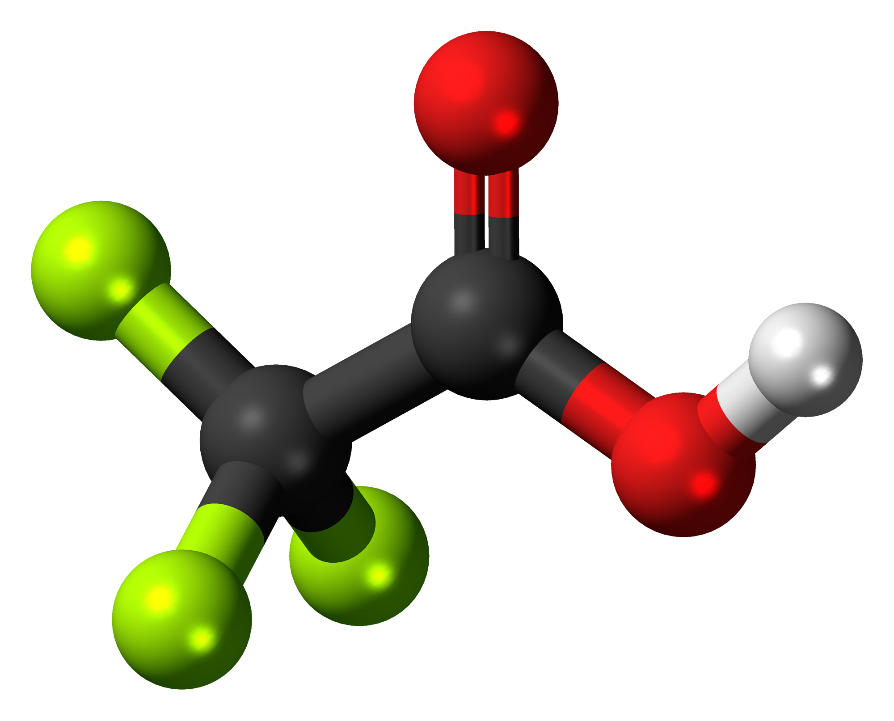
Trifluorättiksyra, är en karboxylsyra med kemisk formel CF3C(O)OH (figur 1). Den betecknas som en stark syra, har hög dielektricitetskonstant, god blandbarhet med vatten samt låg kokpunkt. På grund av dess egenskaper används den ofta i organisk syntes som lösningsmedel, katalysatorer och reaktant. Många kemiska omvandlingar, oxidation/reduktion osv kan göras med hjälp av TFA [1] [2].
Varifrån kommer TFA
Det är väletablerat att TFA är en globalt förekommande komponent i miljön, men osäkerheten råder när det gäller dess huvudsakliga naturliga och antropogena källor [3]. Utsläppen av TFA från industriellt bruk är relativt låga [4], men TFA bildas också vid nedbrytning av ett antal halogenerade kolväten, däribland HFC-134a, HFC-245fa, HFO-1234ze(E) och HFO-1234yf [3]. De nivåer som för närvarande finns i miljön kan inte förklaras enbart utifrån sentida antropogena källor utan antyder att det finns naturliga, förindustriella källor [4].
Den atmosfäriska nedbrytningen av mättade (vanliga HFC-er) och omättade (”HFO-er”) HFC-molekyler, initieras av deras reaktion med OH-radikaler eller ozon (viktigt bara för omättade HFC). De oxiderade produkterna från dessa reaktioner försvinner från atmosfären via regn och kan ansamlas i hav, sjöar och andra reservoarer i ekosystemet.
TFA, som alltså är en potentiellt giftig biprodukt från sönderdelningen av HFC och HFO ansamlas alltså i miljön. Mycket osäkerhet kvarstår dock i vår förståelse av de processer som bidrar till de höga nivåerna av TFA i dagens vattenmiljöer. Borrningar från djupa lager av Grönlands inlandsis ger inga spår av TFA vilket indikerar att det inte finns någon naturlig källa till TFA i sötvatten eller i atmosfären [5]. Den genomsnittliga TFA koncentrationer i djupa hav är däremot större än vad som kan förväntas bara från antropogena källor, vilket tyder på förekomsten av naturliga källor i havet [3]. Enligt vissa källor kan TFA bildas vid vulkanutbrott djupt under havsytan [5].
Miljörisker med TFA
TFA är en stark syra som är mycket resistent mot mikrobiell nedbrytning. Även om biologisk nedbrytning av TFA har observerats under speciella förhållanden, anses relevansen av dessa resultat vad gäller nedbrytning i naturen vara tveksam [4]. Med stor sannolikhet ackumuleras dessa molekyler i marken, i växter samt i akvatiska ekosystem över tid och på längre sikt kan de möjligen påverka växter, djur och ekosystem negativt [6]. Undersökningar har dock visat att toxicitetsgraden i många fall är mycket låg för alger, växter, fiskar, djur och människor [4].
Det lägsta tröskelvärde vid vilket någon effekt av TFA observerats gäller tillväxttakten för en alg, Selenastrum capricornutum. I detta fall uppmättes en märkbar effekt vid en koncentration av 0,12 mg / L av natrium trifluoracetat (salt av TFA) vilket motsvarar 0,1 mg/L av TFA. Baserat på detta betraktas koncentrationer av TFA lägre än 0,1 mg/L som säkra och denna koncentration används därför som ett gränsvärde i olika studier [4][7]. Som framgår av Tabell 1 är tröskelvärdena vad gäller natrium trifluoracetat högre för andra alger och växter.
Hälsorisker vid exponering genom inandning av luft kontaminerad av R-1234yf kan betraktas som försumbara [7].
Tabell 1 – Ekotoxicitet av natrium trifluoracetat [4]
| Lägst observerad concentration som ger effekt |
Koncentration utan observerad effekt |
|
| vattenlevande organismer |
||
| Selenastrum capricornutum (grön sötvattenalg) |
0.36 mg/l |
0.12 mg/L |
| Phaeodactylum tricornutum (havsvattenalg) |
> 117 mg/L |
|
| Lemna gibba (kupandmat) |
600 mg/L |
300 mg/L |
| landlevande växter |
||
| Vete (tillfört till marken) |
10 mg/kg |
1 mg/kg |
| Solros (tillfört till marken) |
1 mg/kg |
< 1 mg/kg |
| Ris (tillfört till bladen) |
100 mg/l |
|
HFO-köldmedier och TFA
Det har uppskattats att av utsläppen av HFC-134a omvandlas 7-20% till TFA. HFO-1234yf, som ju är en ersättare för HFC-134a i mobilkyla, sönderfaller däremot mycket snabbare än HFC-134a och omvandlas fullständigt till TFA [3]. Det bör noteras att sönderfallet till TFA inte är lika fullständig för alla HFO-köldmedier. Till exempel visar en studie att 10-20% av HFO-1234ze(E) bryts ner till TFA [6].
En studie har visat att TFA koncentrationerna orsakade av antropogena källor kan förväntas bli upp till 1000 gånger lägre än det säkra gränsvärdet på 100 μg/l [4]. Studien tog hänsyn till utsläpp av HFC-er som vanligen har långa atmosfäriska livstider och nedbrytningen antogs därför starta efter att utsläppen har blivit väl blandade i atmosfären. Även om man antar att R1234yf kommer att ersätta R134a i alla mobila luftkonditioneringssystem i USA kommer TFA koncentrationen i regnvatten enligt studien i genomsnitt vara 0,89 μg/L, med ett max-värde på 7.8 μg/L vilket alltså är långt under gränsvärdet [8].
Med tanke på den pågående utfasningen av HFC-köldmedier kan det förväntas att användningen av HFO-köldmedier, och blandningar innehållande HFO, ökar i framtiden. I flera studier har man därför försökt uppskatta TFA nivåerna som uppstår om R134a ersätts av HFO-köldmedier. Dessa studier konstaterar att toppnivåerna för TFA kan nå 1,26-1,70 μg/L, vilket är 60-80 gånger lägre än gränsvärdet [6] [9]. Skillnaden mellan dessa resultat jämfört med den föregående studien [4] kan förklaras av den mycket kortare livslängden för HFO-1234yf (16.4 dagar) jämfört med HFC-134a (13.4 år), vilket leder till mer lokala koncentrationstoppar och en mindre global spridning.
En invändning mot detta är att resultaten är baserade på användning av HFO-köldmedier enbart i fordon. Om HFO-köldmedier eller blandningar med HFO får en större spridning, som ersättning för HFC-köldmedier, kan HFO-utsläppen bli betydligt större. Med hänsyn tagen till koncentrationsvariationer orsakade av säsongsvisa variationer i nederbörd och möjligheten att TFA ansamlas i vissa slutna vattensamlingar anser vissa forskare [7] att kvoten mellan beräknade värden och värdena på en säker koncentration för akvatisk toxicitet inte verkar vara tillräckligt stor.
Sammanfattningsvis kan konstateras att hittills publicerade studier indikerar att en global övergång från R134a till R1234yf för mobil luftkonditionering, vid nuvarande användning av sådana system, inte kommer att ge skadliga nivåer av TFA. Men vid en global övergång från HFC-köldmedier till HFO-köldmedier i värmepumpar/kylanläggningar och andra applikationer, är det fortfarande en öppen fråga om skadliga halter av TFA i miljön kommer att uppnås.
Referenser
| [1] |
S. Lopez and J. Salazar, "Trifluoroacetic acid: Uses and recent applications in organic synthesis," Journal of Fluorine Chemistry, vol. 156, pp. 73-100, 2013. |
| [2] |
J. J. Katz, "Anhydrous trifluoroacetic acid as a solvent for proteins," Nature, vol. 174, no. 509, 1954. |
| [3] |
WMO, "Scientific assessment of ozone depletion," 2010. http://www.esrl.noaa.gov/csd/assessments/ozone/2010/ |
| [4] |
J. C. Boutonnet, "Environmental risk assessment of trifluoroacetic acid," Human and ecological risk assessment: an international journal, vol. 5, no. 1, pp. 59-124, 1999. |
| [5] |
F. Dalang, "HFO-1234yf in the environment," 2010. http://www.noe21.org/site/images/stories/Noe21/pdf/HFO_1234yf_ang.pdf |
| [6] |
W. Carter, "Investigation of atmospheric ozone impacts of trans 1,3,3,3-tetrafluoropropene," 2009. http://www.cert.ucr.edu/~carter/pubs/ZEErept.pdf |
| [7] |
H. Kajihara, "Estimation of environmental concentrations and deposition fluxes of R-1234-YF and its decomposition products emitted from air conditioning equipment to atmosphere," in International symposium on next-generation air conditioning and refrigeration technology, Tokyo, 2010. |
| [8] |
J. Kazil, S. McKeen, S.-W. Kim, R. Ahmadov, G. A. Grell, R. K. Talukdar and A. R. Ravishankara, "Deposition and rainwater concentrations of trifluoroacetic," JournalofGeophysicalResearch: Atmospheres, vol. 119, pp. 14059-14079, 2014. |
| [9] |
D. Lueken, "Ozone and TFA impacts in North America from degradation of 2,3,3,3-tetrafluoropropene (HFO-1234yf), a potential greenhouse gas replacement," Environ. Sci. Technol., vol. 44, pp. 343-348, 2010. |
